核糖体是细胞内蛋白质合成中心。肿瘤细胞的特征之一是核糖体功能提升以满足其快速生长所需的蛋白质合成。因此,抑制核糖体功能被认为是肿瘤治疗的重要策略。研究表明,核糖体抑制剂通过激活JNK、p38等信号通路产生核糖体毒性应激损伤(Ribotoxic Stress),从而促进肿瘤细胞凋亡。高三尖杉酯碱(Homoharringtonine, HHT)是一种从三尖杉酯中分离出来的植物生物碱,是我国自主研制的一种治疗白血病的临床药物。HHT可结合在核糖体肽基转移酶中心从而阻断蛋白质合成。迄今HHT是唯一用于临床癌症治疗的核糖体抑制剂,在世界上广泛应用于急性非淋巴细胞白血病的治疗。然而,临床研究表明,实体肿瘤包括头颈癌、乳腺癌、结直肠癌、肾癌等对HHT治疗响应差,其原因尚不清楚。因此,阐明实体肿瘤细胞抵抗HHT的分子机制,对于拓展HHT以及基于核糖体抑制在肿瘤治疗中的应用具有重要意义。
近日,四川大学生命科学学院肖智雄/易勇团队在Nature Communications在线发表了题为USP36 stabilizes nucleolar Snail1 to promote ribosome biogenesis and cancer cell survival upon ribotoxic stress的研究论文。该研究揭示核仁Snail1促进的核糖体生物合成是肿瘤细胞抵抗HHT/核糖体毒性应激的关键机制。

Snail1蛋白作为EMT(上皮-间充质转化)的重要转录因子主要定位于核质中,在肿瘤生存、转移、及干性等方面发挥着重要调控作用。本研究发现, HHT可显著促进Snail1蛋白在核仁中聚集(图一),增加的Snail1蛋白通过上调47S rRNA的表达,从而促进核糖体生物合成及肿瘤细胞存活。
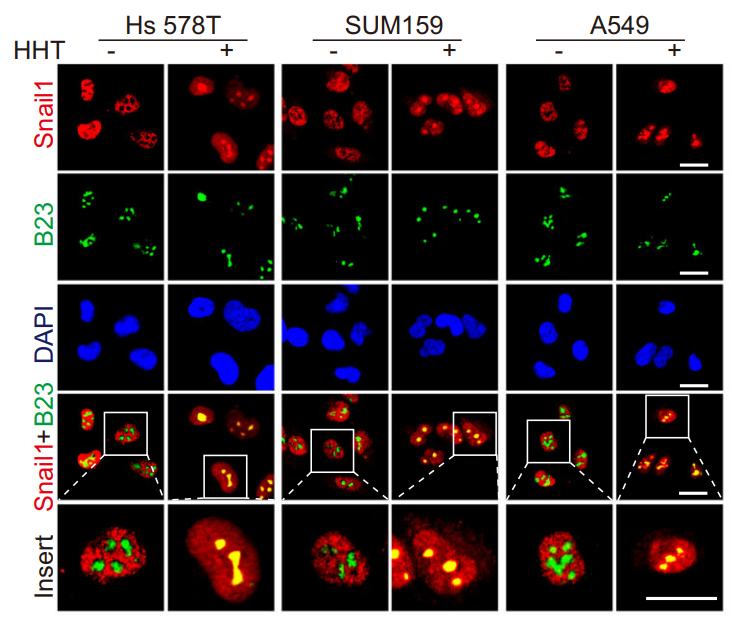
图一.核糖体毒性应激促进Snail1蛋白在核仁中聚集。
分子机制上,该研究发现核质中的Snail1蛋白通过扩散进入核仁,但核仁中的Snail1蛋白不稳定。HHT通过激活JNK-HSF1信号通路,上调核仁去泛素化酶USP36表达;USP36通过去除核仁Snail1蛋白K146及K206的多泛素化从而稳定Snail1蛋白,进而导致Snail1蛋白在核仁中聚集(图二)。重要的是,本研究发现HHT可显著激活实体肿瘤细胞中JNK-USP36-Snail1信号轴,但在白血病细胞中却不能激活这一通路。这为临床上HHT能有效治疗白血病,但对实体肿瘤却无效提供了理论基础。此外,本研究发现联合HHT及JNK抑制剂可显著抑制体外肿瘤细胞存活及体内实体肿瘤生长。
综上,该研究表明激活JNK-USP36-Snail1信号通路是实体肿瘤抵抗核糖体毒性应激的关键分子机制,联合HHT及JNK-USP36-Snail1通路抑制剂是一种潜在的实体肿瘤治疗新策略。
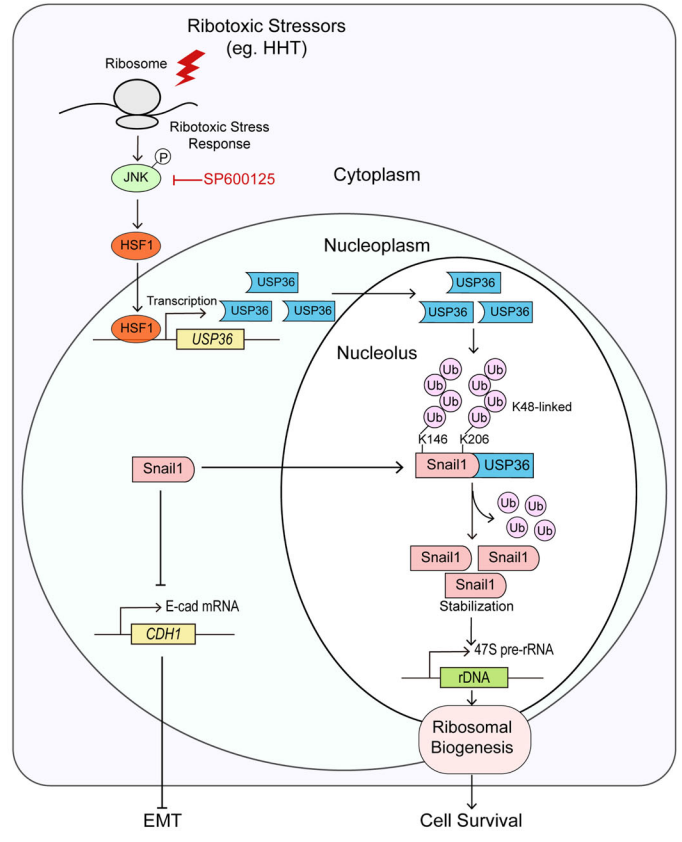
图二. 本研究的工作模式图。
四川大学生命科学学院秦可为博士和喻姝菡博士为该论文的第一作者,四川大学生命科学学院肖智雄教授和易勇副研究员为共同通讯作者。四川大学生物治疗国家重点实验室戴伦治教授,四川大学生命科学学院张渝君教授、曹洋副教授、牛孟孟副研究员,成都医学院陈虎副教授参与了这项研究。本研究得到了国家自然科学基金、四川省自然科学基金等项目的支持。
原文链接:https://www.nature.com/articles/s41467-023-42257-8
